บัฟเฟอร์(Buffer)
สาร ละลายบัฟเฟอร์ = สารละลายของกรดอ่อนกับเกลือของกรดนั้น or สารละลายเบสอ่อนกับเกลือของเบสนั้น(อ่อนคู่เกลือ)สมบัติของ Buffer = สามารถควบคุมค่า pH ได้เมื่อเติมกรดแก่หรือเบสแก่ลงไปเล็กน้อย
การควบคุมค่า pH ของ Buffer
บัฟเฟอร์Aมีสาร CH3COOH กับ CH3COO- อยู่ในระบบ
CH3COOH + OH-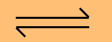 CH3COO- + H2O
CH3COO- + H2O
****กรดแก่&เบสแก่เป็น Buffer ไม่ได้เพราะแตกตัว 100 % จึงไม่เกิดคู่กรดคู่เบส****
ชนิดของ Buffer 1.คู่เหมือนไม่ทำปฏิกิริยากัน Ex. CH3COOH กับ CH3COONa
2.บัฟเฟอร์คู่กรด คู่เบส ของกรดอ่อนกับเกลือของกรดอ่อน3. บัฟเฟอร์คู่กรด คู่เบส ของเบสอ่อนกับเกลือของเบสอ่อน
2.ถ้าทำปฏิกิริยากันอ่อนต้องเหลือ
การดูค่า pH ของ สารละลายBuffer
1.บัฟเฟอร์ที่เกิดจากกรดอ่อนคู่กับเกลือของกรดอ่อน มี pH <7
2.บัฟเฟอร์ที่เกิดจากเบสอ่อนคู่กับเกลือของเบสอ่อน มี pH >7
pHของ Buffer ใช้สูตร pH = -logKa + log [เกลือ]/[กรด]
pOHของ Buffer ใช้สูตร pOH = -logKb + log [เกลือ]/[เบส]
**** สารละลายบัฟเฟอร์จะมีประสิทธิภาพดีที่สุดเมื่อ [HA] = [A-]ซึ่งจะทำให้ [H+]จะเท่ากับ Ka ด้วยเหตุนี้จึงเลือกใช้บัฟเฟอร์ที่มีค่า pKaใกล้เคียงกับ pH ที่ต้องการเตรียม****
สาร ละลายบัฟเฟอร์ = สารละลายของกรดอ่อนกับเกลือของกรดนั้น or สารละลายเบสอ่อนกับเกลือของเบสนั้น(อ่อนคู่เกลือ)สมบัติของ Buffer = สามารถควบคุมค่า pH ได้เมื่อเติมกรดแก่หรือเบสแก่ลงไปเล็กน้อย
การควบคุมค่า pH ของ Buffer
บัฟเฟอร์Aมีสาร CH3COOH กับ CH3COO- อยู่ในระบบ
ถ้าใส่กรดลงไป HCl จะแตกให้ H+ แต่จะถูกสะเทินด้วยคู่เบส
CH3COO- + H+ 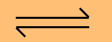 CH3COOH
CH3COOH
ถ้าใส่เบสลงไป NaOH จะแตกตัวให้ OH- แต่จะถูกสะเทินด้วยคู่กรด CH3COOH + OH-
****กรดแก่&เบสแก่เป็น Buffer ไม่ได้เพราะแตกตัว 100 % จึงไม่เกิดคู่กรดคู่เบส****
ชนิดของ Buffer 1.คู่เหมือนไม่ทำปฏิกิริยากัน Ex. CH3COOH กับ CH3COONa
2.บัฟเฟอร์คู่กรด คู่เบส ของกรดอ่อนกับเกลือของกรดอ่อน3. บัฟเฟอร์คู่กรด คู่เบส ของเบสอ่อนกับเกลือของเบสอ่อน
หลักการการดูสารว่าเป็น Buffer หรือไม่
1.ถ้าไม่ทำปฏิกิริยากัน(คู่เหมือน)ตัดแก่ออกจะต้องมี H+ ต่าง 1ตัว2.ถ้าทำปฏิกิริยากันอ่อนต้องเหลือ
การดูค่า pH ของ สารละลายBuffer
1.บัฟเฟอร์ที่เกิดจากกรดอ่อนคู่กับเกลือของกรดอ่อน มี pH <7
2.บัฟเฟอร์ที่เกิดจากเบสอ่อนคู่กับเกลือของเบสอ่อน มี pH >7
pHของ Buffer ใช้สูตร pH = -logKa + log [เกลือ]/[กรด]
pOHของ Buffer ใช้สูตร pOH = -logKb + log [เกลือ]/[เบส]
**** สารละลายบัฟเฟอร์จะมีประสิทธิภาพดีที่สุดเมื่อ [HA] = [A-]ซึ่งจะทำให้ [H+]จะเท่ากับ Ka ด้วยเหตุนี้จึงเลือกใช้บัฟเฟอร์ที่มีค่า pKaใกล้เคียงกับ pH ที่ต้องการเตรียม****
ไม่มีความคิดเห็น:
แสดงความคิดเห็น