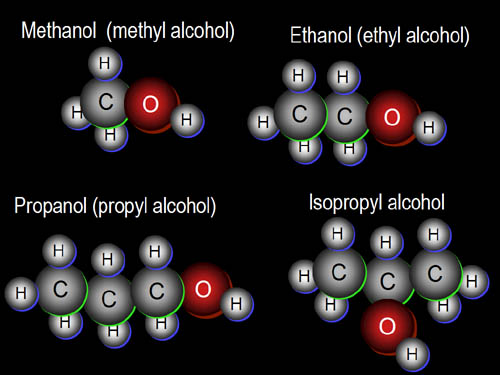
Alkane
แอลเคน มีชื่อเรียกอีกอย่างหนึ่งว่า พาราฟิน ไฮโดรคาร์บอน (parafin hydrocarbon) หรือเรียกสั้นๆ ว่า พาราฟิน เป็นสารประกอบไฮโดรคาร์บอนอิ่มตัว มีสูตรทั่วไปเป็น CnH2n + 2 เมื่อ n = 1, 2, 3, … เช่น
ถ้า n = 1 จะได้ CH4
ถ้า n = 2 จะได้ C2H6
ถ้า n = 3 จะได้ C3H8 ฯลฯ
จะเห็นได้ว่าเมื่อ C เพิ่ม 1 อะตอม H จะเพิ่ม 2 อะตอม หรือเพิ่มครั้งละ - CH2
แอลเคนมีทั้งที่เกิดในธรรมชาติ เช่นน้ำมันดิบ (coal tar) น้ำมันปิโตรเลียม และก๊าซธรรมชาติ นอกจากนี้ยังสามารถสังเคราะห์ขึ้นมาได้
ตัวแรกของอนุกรมแอลเคนคือ มีเทน มีสูตรเป็น CH4
รูปร่างโมเลกุลของแอลเคนเป็นทรงเหลี่ยมสี่หน้า มีมุมระหว่างพันธะ 109.5 องศา
การเรียกชื่อแอลเคน
การเรียกชื่อแอลเคนเป็นไปตามหลักการเรียกชื่อสารอินทรีย์ที่กล่าวมาแล้ว ในที่นี้จะแสดงทั้งการเรียกชื่อแบบสามัญ และแบบ IUPAC
ก. การเรียกชื่อแอลเคนแบบสามัญ
ใช้เรียกชื่อโมเลกุลเล็กๆ ที่ไม่ซับซ้อน ถ้าโมเลกุลใหญ่ขึ้นอาจจะต้องเติมคำนำหน้า เช่น n- , iso- , หรือ neo- ลงไปด้วย
ข. การเรียกชื่อแอลเคนในระบบ IUPAC
มีหลักการเรียกชื่อดังนี้
1. ถ้าเป็นโมเลกุลสายยาว ไม่มีกิ่ง ให้เรียกชื่อโครงสร้างหลักตามจำนวนคาร์บอนที่มี แล้วลงท้ายด้วย - ane (เ - น) เช่น
CH3-CH2-CH2-CH3 มีคาร์บอน 4 อะตอมเรียกว่า บิวเทน (butane = but +ane)
CH3-CH2-CH2-CH2-CH3 มีคาร์บอน 5 อะตอมเรียกว่า เพนเทน (pentane = pent +ane)
CH3-CH2-CH2-CH2- CH2-CH3 มีคาร์บอน 6 อะตอมเรียกว่า เฮกเซน (hexane = hex +ane)
2. ถ้าเป็นโมเลกุลสายยาวที่มีกิ่ง ให้เลือกโครงสร้างหลักที่คาร์บอนต่อกันเป็นสายยาวที่สุดก่อนเรียกชื่อโครงสร้างหลักแล้วลงท้ายด้วย -ane (เ - น) หลังจากนั้นจึงพิจารณาส่วนที่เป็นกิ่ง
3.ส่วนที่เป็นกิ่ง เรียกว่าหมู่แอลคิล การเรียกชื่อหมู่แอลคิลมีหลักการดังนี้
หมู่อัลคิล (alkyl group) หมายถึง หมู่ที่เกิดจากการลดจำนวนอะตอมของไฮโดรเจนในแอลเคน 1 อะตอม หรือ หมู่แอลคิลคือแอลเคนที่ไฮโดรเจนลดลง 1 อะตอมนั่นเอง เขียนสูตรทั่วไปเป็น -R โดยที่ R = CnH2n + 1
ตัวอย่างแอลเคนและหมู่แอลคิล
แอลเคน (R-H) | แอลคิล (-R) |
CH4 C2H6 C3H8 C4H10 C5H12 | -CH3 -C2H5 -C3H7 -C4H9 -C5H11 |
การเรียกชื่อหมู่อัลคิล
เรียกเหมือนกับอัลเคน แต่เปลี่ยนคำลงท้ายจาก -ane เป็น -yl พวกแอลคิลหมู่เล็กๆ มักนิยมเรียกชื่อแบบสามัญ แต่ถ้าโครงสร้างซับซ้อนต้องเรียกชื่อตามระบบ IUPAC ดังเช่นตัวอย่างต่อไปนี้
จำนวน | แอลเคน | หมู่แอลคิล |
C อะตอม | โครงสร้าง | ชื่อ | โครงสร้าง | ชื่อ |
1 | CH4 | มีเทน (methane) | -CH3 | เมทิล (methyl) |
2 | CH3 - CH3 | อีเทน (ethane) | -CH2 - CH3 | เอทิล (ethyl) |
3 | CH3- CH2 -CH3 | โพรเพน (propane) | -CH2 - CH2 - CH3 | โพรพิล (propyl) |
| | |
| ไอโซโพรพิล (isopropyl) |
4 | CH3 - CH2 -CH2 - CH3 | บิวเทน (butane) | -CH3-CH2-CH2-CH3 | บิวทิล (butyl) |
| | |
| เซคอนดารี-บิวทิล (secondary-butyl หรือ sec-butyl) |
| | |
| เทอเซียรี่-บิวทิล (tertiary butyl หรือ tert-butyl) |
|
| ไอโซบิวเทน (isobutane) |
| ไอโซบิวทิล (isobutyl) |
5 | CH3-CH2 -CH2 -CH2 -CH3 | เพนเทน (pentane) | -CH2-CH2-CH2-CH2 -CH3 | เพนทิล หรือ นอร์มอล-เพนทิล (pentyl หรือ n-pentyl หรือ sec-pentyl) |
|
| นิโอเพนเทน |
| นีโอเพนทิล (neopentyl) |
|
| ไอโซเพนเทน |
| ไอโซเพนทิล (isopentyl) |
| | |
| เทอเซียรี่-เพนทิล tert-pentyl |
4.การนับจำนวนคาร์บอนในโครงสร้างหลักเพื่อบอกตำแหน่งของหมู่แอลคิล ให้ใช้ตัวเลขที่มีค่าน้อยที่สุด
5.ตรวจดูว่ามีหมู่แอลคิลอะไรบ้าง ต่ออยู่กับคาร์บอนตำแหน่งไหนของโครงสร้างหลักให้เรียกชื่อหมู่แอลคิลนั้นโดยเขียนเลขบอกตำแหน่งไว้หน้าชื่อพร้อมกับมีขีด ( - ) คั่นกลาง เช่น
2-methyl, 3-methyl , 3-ethyl ฯลฯ
6.ถ้ามีหมู่แอลคิลที่เหมือนกันหลายหมู่ ให้บอกตำแหน่งทุก ๆ หมู่ และบอกจำนวนหมู่ด้วยภาษาละติน เช่น di = 2, tri = 3 , tetra = 4 , penta = 5 , hexa = 6 , hepta = 7 , octa = 8 , nona = 9 , deca = 10 เป็นต้น เช่น
2, 3 - dimethyl ,
3, 3 , 4 - trimethyl
7.ถ้ามีหมู่แอลคิลต่างชนิดมาต่อกับโคงสร้างหลัก ให้เรียกทุกหมู่ตามลำดับตัวอักษรภาษาอังกฤษ (ไม่รวมจำนวนหมู่ เช่น di, tri , tetra) พร้อมกับบอกตำแหน่งของหมู่แอลคิลแต่ละหมู่ เช่น
3-ethyl - 2 - methyl ,
3 - ethyl - 2, 3 - dimethyl
8.ถ้าหมู่แอลคิลมคาร์บอนไม่เกิน 4 อะตอมมักจะเรียกแบบชื่อสามัญ แต่ถ้ามากกว่านี้และเรียกชื่อสามัญไม่ได้ให้เรียกตามระบบ IUPAC
9.ชื่อของหมู่แอลคิลและชื่อโครงสร้างหลักต้องเขียนติดกัน
ตารางแสดง ชื่อในระบบ IUPAC ของแอลเคนที่คาร์บอนต่อกันเป็นสายยาว 10 ตัวแรก
จำนวนอะตอมของคาร์บอน | สูตรโครงสร้าง | ชื่อ |
1 2 3 4 5 6 7 8 9 10 | CH4 CH3 - CH3 CH3 - CH2 - CH3 CH3 - (CH2)2 - CH3 CH3 - (CH2)3 - CH3 CH3 - (CH2)4 - CH3 CH3 - (CH2)5 - CH3 CH3 - (CH2)6 - CH3 CH3 - (CH2)7 - CH3 CH3 - (CH2)8 - CH3 | มีเทน (methane) อีเทน (ethane) โพรเพน (propane) บิวเทน (butane) เพนเทน (pentane) เฮกเซน (hexane) เฮปเทน (heptane) ออกเทน (octane) โนเนน (nonane) เดกเซน (decane) |
ไอโซเมอร์ของแอลเคน
แอลเคนจะเริ่มมีไอโซเมอร์เมื่อโมเลกุลมี C 4 อะตอมขึ้นไป และเมื่อ C ในโมเลกุลเพิ่มขึ้นจำนวนไอโซเมอร์จะเพิ่มขึ้นด้วย
จำนวนคาร์บอน | สูตรโมเลกุล | จำนวนไอโซเมอร์ |
4 5 6 7 9 10 15 20 30 | C4H10 C5H12 C6H14 C7H16 C9H20 C10H22 C15H32 C20H42 C30H62 | 2 3 5 9 35 75 4347 336319 411846763 |
การเตรียมแอลเคน
ก. เตรียมได้จากแหล่งกำเนิดในธรรมชาติ แหล่งกำเนิดของแอลเคนในธรรมชาติได้แก่ ปิโตรเลียม และก๊าซธรรมชาติ ซึ่งขนาดของโมเลกุลมีตั้งแต่คาร์บอน 1 อะตอม ถึง 40 อะตอม ในก๊าซธรรมชาติส่วนใหญ่จะเป็นแอลเคนที่กลายเป็นไอได้ง่าย มวลโมเลกุลค่อนข้างต่ำ ประกอบด้วยมีเทน 70-90% อีเทน 13 - 15% นอกจากนั้นเป็นโพรเพน และบิวเทน และบางส่วนของสารที่โมเลกุลขนาดใหญ่แต่กลายเป็นไอได้ง่ายปนอยู่ด้วย สำหรับปิโตรเลียมส่วนใหญ่ประกอบด้วยไฮโดรคาร์บอนที่เป็นของเหลว และของแข็งปนกัน การแยกแอลเคนเหล่านี้ออกจากกันจะใชการกลั่นลำดับส่วน
ข. เตรียมจากการสังเคราะห์ โดยเตรียมในห้องปฏิบัติการดังนี้
1.เตรียมจากแอลคีน (catalytic reduction of alkene) โดยนำแอลคีนมาเติม H2 โดยมีคะตะไลส์เช่น Ni หรือ Pt เรียกปฏิกิริยานี้ว่า ไฮโดรจิเนชัน (hydrogenation)
2.เตรียมจากปฏิกิริยาระหว่าง อัลคิลเฮไลด์ (alkyl halide) กับโลหะและกรด
CH3 - CH2 - Cl + Zn + H+ ® CH3 - CH3 + Zn2+ + Cl-
3.เตรียมจากปฏิกิริยาระหว่างอัลคิลเฮไลด์ (alkyl halide) กับ Na ซึ่งเรียกว่า Wurtz reaction เช่น
2CH3 - Cl + 2Na ® CH3 - CH3 + 2NaCl
4.การเตรียมมีเทนในห้องปฏิบัติการใช้ปฏิกิริยาระหว่างอลูมิเนียมคาร์ไบต์ (Al4C3) กับน้ำอุ่นหรือกรด HCl เจือจาง
Al4C3 + 12H2O ® 4Al(OH)3 + 3CH4
Al4C3 + 12HCl ® 4AlCl3 + 3CH4
ปฏิกิริยาของแอลเคน
โดยทั่วๆ ไปแอลเคนเป็นสารประกอบที่ค่อนข้างเฉื่อย เกิดปฏิกิริยากับสารเคมีต่างๆ ที่อุณหภูมิห้องช้า จึงได้เรียกอีกอย่างหนึ่งว่า พาราฟิน (parafin) ซึ่งมาจากภาษาละตินคือ parum affinis ซึ่งหมายถึงไม่ถูกทำลายด้วยกรด เบส ตัวออกซิไดส์ หรือตัวรีดิวซ์ จึงไม่เหมาะแก่การทดลองในห้องปฏิบัติการ แต่ในกระบวนการทางอุตสาหกรรมสามารถทำให้เกิดปฏิกิริยาได้
เนื่องจากแอลเคนเป็นสารประกอบของคาร์บอนที่อิ่มตัวจึงไม่เกิดปฏิกิริยาการเติม แต่จะเกิดปฏิกิริยาการแทนที่โดยมีปฏิกิริยาที่สำคัญดังนี้
1. ปฏิกิริยาการเผาไหม้ (combustion oxidation)
เมื่อแอลเคนทำปฏิกิริยากับออกซิเจนจะติดไฟได้ง่าย ไม่มีเขม่าและคายความร้อนมากซึ่งเป็นเหตุผลหนึ่งที่ใช้แอลเคนเป็นเชื้อเพลิง เขียนเป็นสมการทั่ว ๆ ไปได้ดังนี้
CxHy + ( x + y/4 )O2 ® xCO2 + y/2H2O
เช่น
C5H12 + 8O2 ® 5CO2 + 6H2O + heat
2C2H6 + 7O2 ® 4CO2 + 6H2O + heat
2.ปฏิกิริยาการแทนที่ (substitution reaction) หมายถึง ปฏิกิริยาที่ ไฮโดรเจน ในแอลเคนถูกแทนที่ด้วยอะตอมหรือกลุ่มอะตอมอื่น ๆ ถ้าถูกแทนที่ด้วยธาตุเฮโลเจน เช่น Cl2 , Br2 จะเรียกว่าปฏิกิริยา ฮาโลจิเนชัน (halogenation) โดยถ้าใช้ Cl2 จะเรียกเป็นชื่อเฉพาะว่าปฏิกิริยา คลอริเนชัน (chlorination) และถ้าใช้ Br2 จะเรียกปฏิกิริยา โบรมิเนชัน (bromination) สำหรับ F2 ไม่ใช้เพราะเกิดปฏิกิริยารุนแรง I2 ไม่ใช้เพราะเป็นของแข็งซึ่งไม่ไวต่อการเกิดปฏิกิริยาทั้งนี้ปฏิกิริยาที่จะเกิดขึ้นได้ต้องมีแสงสว่างเป็นตัวช่วย
ในปฏิกิริยาฮาโลจิเนชันของแอลเคนจะได้ผลิตภัณฑ์เป็น อัลคิลเฮไลด์ (alkyl halide) และก๊าซ ไฮโดรเจนเฮไลด์ เขียนเป็นสมการทั่ว ๆ ไปดังนี้
แสง
CnH2n +2 + X2 ® CnH2n + 1X + HX
3.ปฏิกิริยาการแตกสลาย (cracking or pyrolysis) เป็นปฏิกิริยาที่ทำให้แอลเคนโมเลกุลใหญ่ๆ สลายตัวกลายเป็นโมเลกุลที่เล็กลง โดยการเผาแอลเคนในภาชนะที่อุณหภูมิประมาณ 400-600 0C พร้อมทั้งมีตัวเร่งปฏิกิริยา






.png)